加利福尼亚州南旧金山 - 2018 年 6 月 8 日 - 罗氏集团(六:RO,ROG;OTCQX:RHHBY)成员基因泰克今天宣布,美国食品药品监督管理局(FDA)已批准 Venclexta(维奈克拉) 与利妥昔单抗联合用于治疗患有慢性淋巴细胞白血病( CLL ) 或小淋巴细胞淋巴瘤 (SLL) 的患者,无论是否有 17p 缺失,这些患者之前至少接受过一种治疗。维奈克拉 由 AbbVie 和罗氏集团成员基因泰克开发。它由美国的公司联合商业化,并由美国以外的 AbbVie 商业化。
“我们很高兴这一批准使维奈克拉 成为同类首创的靶向治疗药物,可用于更多在先前治疗后疾病复发的慢性淋巴细胞白血病患者,”首席医疗官兼负责人 Sandra Horning 医学博士说。全球产品开发。“与标准护理疗法相比,维奈克拉加 利妥昔单抗提供了一种新的无化疗选择,可帮助人们在疾病没有进展的情况下活得更久。”
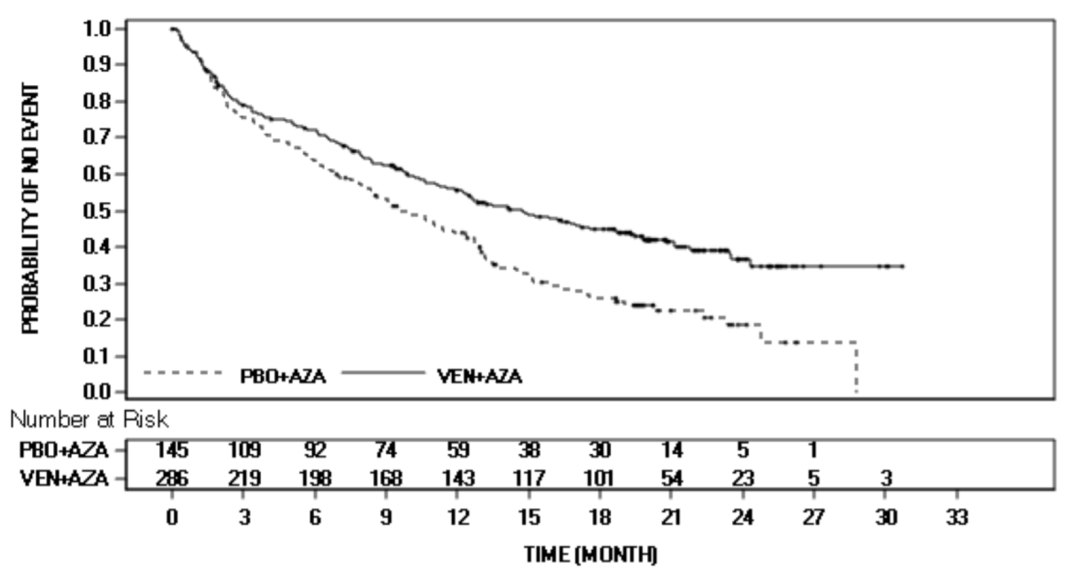
维奈克拉加利妥昔单抗用于既往接受过治疗的 CLL 患者的批准主要基于 III 期 MURANO 研究的结果,该研究于 2018 年 3 月在线发表在新英格兰医学杂志上,并在美国血液学会年会上发表2017 年 12 月。结果显示,与苯达莫司汀加 Rituxan(目前的护理标准)相比,Venclexta 加 Rituxan 的固定疗程治疗显着降低了疾病进展或死亡(无进展生存期;PFS)的风险 81%(HR= 0.19;95% CI 0.13-0.28;p<0.0001)。
维奈克拉加利妥昔单抗联合使用最常见的副作用包括白细胞计数低、腹泻、上呼吸道感染、咳嗽、疲劳和恶心。
今天的 FDA 批准将 Venclexta 的加速批准转变为完全批准。FDA 还更新了 Venclexta 作为单一药物的适应症,现在批准用于治疗至少接受过一种既往治疗的 CLL 或 SLL 患者,无论是否有 17p 缺失。Venclexta 曾于 2016 年 4 月获得加速批准,作为单一药物用于治疗 CLL 患者,该患者通过 FDA 批准的测试检测到 17p 缺失,这些患者之前至少接受过一次治疗。
基于 MURANO 数据的补充新药申请( sNDA )获得优先审评,这是 FDA 确定有可能显着改善疾病治疗、预防或诊断的药物的指定。FDA 此前还授予 Venclexta 与 Rituxan 联合治疗复发或难治性 CLL 的突破性治疗指定。美国国家综合癌症网络 (NCCN) 指南推荐 Venclexta 联合 Rituxan 作为既往治疗过的 CLL(1 类,首选)的治疗选择。
基于 MURANO 数据的上市许可变更申请也已提交给欧洲药品管理局(EMA)并得到验证。正在向世界各地的卫生当局提交更多 MURANO 数据。
关于MURANO研究
MURANO (NCT02005471) 是一项 III 期开放标签、国际、多中心、随机研究,评估 Venclexta 联合 Rituxan 与苯达莫司汀联合 Rituxan (BR) 相比的疗效和安全性。所有治疗的持续时间都是固定的。在 Venclexta 为期五周的剂量递增计划之后, Venclexta 加 Rituxan 组的患者接受了六个周期的 Venclexta 加 Rituxan ,随后接受了 Venclexta 单一疗法,总共长达两年。BR 组的患者接受了六个周期的 BR。该研究包括 389 名慢性淋巴细胞白血病 (CLL) 患者,他们之前至少接受过一种治疗。患者以 1:1 的比例被随机分配接受 Venclexta 加 Rituxan 或 BR。该研究的主要终点是无进展生存期(PFS)。
与 BR 相比,接受 Venclexta 加 Rituxan 治疗的患者发生频率至少高出 2% 的常见 3 级或更高级别不良反应分别为低白细胞计数(中性粒细胞减少症,62% 与 44%)、腹泻(3% 与 44%)。 1%)和肿瘤溶解综合征(3% 对 1%)。
资料来源:基因泰克